News
ASH 2024: CD19-Expression nach Tafasitamab

Für eine sequentielle Abfolge CD19-gerichteter Therapien ist es wichtig zu verstehen, ob die Zielstruktur durch die möglichen Therapieoptionen verändert oder beeinflusst wird. Eine am ASH 2024 vorgestellte Analyse zeigte, dass die CD19-Expression nach der Therapie mit Tafasitamab erhalten blieb.1
Mehrere Therapieoptionen des R/R DLBCL richten sich gegen das B-Zell-Oberflächenprotein CD19. Dazu gehören der monoklonale Antikörper Tafasitamab, mehrere CAR-T-Zelltherapien und Antikörper-Wirkstoff-Konjugate. Um über mögliche Therapiesequenzen entscheiden zu können, ist es von großer Relevanz, ob sich die Zielstruktur oder deren Expressionsmuster während oder aufgrund der CD19-gerichteten Behandlung verändert.2
Eine am ASH Kongress in San Diego präsentierte Analyse zeigte, dass CD19 nach der Therapie mit Tafasitamab auf den B-Zellen erhalten blieb und sich genetisch nicht relevant veränderte. Das haben Forscherinnen und Forscher des Universitätsklinikums Würzburg in Zusammenarbeit mit dänischen Kollegen anhand von Proben einer größeren Patientenzahl ermittelt. Dieser Befund bedeutet, dass CD19 auch etwaigen nachfolgenden CD19-gerichteten Therapien weiterhin als Zielstruktur dienen kann.1,3
Dr. med. Johannes Düll (Hämatologie) und Dr. rer. nat. Hilka Rauert-Wunderlich (Pathologie), beide vom Universitätsklinikum Würzburg und an der Studie beteiligt, diskutierten die Bedeutung dieser Ergebnisse und teilen zudem praktische Hinweise für den Nachweis von CD19. Die Videoaufzeichnung des Expertengesprächs kann hier angeschaut werden.3
CD19 nachweisbar und nicht mutiert
Die Expression von CD19 wurde in Biopsaten von insgesamt 31 R/R DLBCL-Patienten mittels IHC analysiert.1 Die Patienten hatten im Rahmen von klinischen Studien oder im Real-World-Setting Tafasitamab erhalten und die Proben waren nach Behandlung (Zeitpunkt des Studieneinschlusses) entnommen worden. Dr. rer. nat. Rauert-Wunderlich fasst zusammen, dass alle Patienten – bis auf einen, der bereits vorab bereits CD19-negativ war – nach der Behandlung eine deutliche CD19-Positivität im Tumor zeigten.1,3
Die CD19-Mutationsanalyse wiederum wurde in Tumorgewebe- und Blutproben von 11 Patienten, die Tafasitamab zur Behandlung verschiedener Neoplasien erhalten hatten, mittels NGS vorgenommen.1 Das Ergebnis: Bei keinem der Patienten wurden nach der Therapie relevante somatische Mutationen im Gen für CD19 aufgefunden.1,3
Praktische Hinweise zum CD19-Nachweis
Im Rahmen der Untersuchungen haben die Wissenschaftler viele praxisrelevante Erfahrungen mit der Detektion von CD19 gesammelt. Eine Detektion mittels Immunhistochemie (IHC) sei, laut der beiden Autoren im Expertengespräch, die Methode der Wahl, um vergleichsweise einfach und eindeutig das Vorhandensein von CD19 nachzuweisen. Alle in der Untersuchung eingesetzten, kommerziell erhältlichen Antikörper zur Detektion hätten gut funktioniert. Solche, die an die extrazelluläre Domäne von CD19 binden, sollten aber bevorzugt werden. Dr. rer. nat. Rauert-Wunderlich ermutigt zum Einsatz der CD19-Testung mit den Worten: “In unserem automatisierten Workflow waren die Assays mit einer kurzen Austestungsphase schnell zu etablieren.”3
Biopsieren im Rezidiv bleibt wichtig
Mit Blick auf die Ergebnisse dieser Studie und heutigen zielgerichteten Therapien beim R/R DLBCL spricht sich Dr. med. Düll im Expertengespräch dafür aus mehr zu biopsieren: “Wir müssen, bevor wir starten wissen, was wir da haben. Und das gilt nicht nur für Tafasitamab.” Der CD19-Nachweis sollte im Standardpanel der Pathologen enthalten sein.3
News
ASH 2024: Relevanz von Dosis-Intensität und Therapielinie

Eine spanische Real-World Analyse zum Einsatz von Tafasitamab und Lenalidomid hat die Ergebnisse der pivotalen Studie L-MIND weitgehend reproduziert. Prof. Peter Borchmann (Köln) und Dr. Johannes Düll (Würzburg) ordnen die Daten ein und teilen Erfahrungen und Empfehlungen für den klinischen Alltag.
Die retrospektive, multizentrische Beobachtungsstudie der spanischen Studiengruppe GELTAMO analysierte eine ähnliche Anzahl von Patienten mit R/R DLBCL wie auch in der pivotalen Phase-II Studie L-MIND eingeschlossen war (n=83, bzw. n=80)1,2 Obwohl die Populationen beider Studien markante Unterschiede aufwiesen, waren die Wirksamkeits- und Sicherheitsdaten bemerkenswert vergleichbar, wie auch die Lymphom-Experten Prof. Borchmann (Köln) und Dr. Düll (Würzburg) im Rahmen einer Kongressberichterstattung vom ASH annual meeting in San Diego eruierten.
Die Videoaufzeichnung des Expertengesprächs kann in der Meet-Incyte I Mediathek angeschaut werden. Die Slides der Experten stehen hier zum Download bereit.
So war das GELTAMO Versorgungskollektiv im Durchschnitt bedeutend älter als die Patienten der L-MIND-Studie (78 vs. 72 Jahre) und hatte einen schlechteren Allgemeinzustand (ECOG PS >1 bei 32% vs. 9%).1,2 73% der Patienten in der Real-World-Studie hätten die L-MIND-Einschlusskriterien nicht erfüllt, unter anderem weil eine primär refraktäre Erkrankung vorlag (58%). Dennoch war die Wirksamkeit von Tafasitamab und Lenalidomid in beiden Analysen vergleichbar, insbesondere in Bezug auf das Ansprechen (ORR und CR) und das progressionsfreie Überleben (PFS) (Tab. 1).
Tabelle 1: Übersicht der Analysen: Spanische Real-World Daten und L-MIND Studie.1,2
Eine weitere Auswertung der Beobachtungsstudie zeigte zudem, dass die Dosierung von Lenalidomid in Zusammenhang mit der Effektivität des Therapieregimes stand.1 So betrug bei einer relativen Lenalidomid Dosis-Intensität von ≥87% vs. 1 Dr. Düll teilte praxis-nahe Erfahrungswerte zum Management von Neutropenien aus der Uniklinik Würzburg. Er diskutierte zudem im Expertenaustausch, welche Patienten von der Therapie mit Tafasitamab plus Lenalidomid profitieren könnten.
Prof. Borchmann schlussfolgerte aus der neuen Datenlage folgendermaßen: “Wenn Patienten nicht CAR-T-fähig sind, sollte man dieses Therapieprinzip besser früher benutzen, um den vollen Nutzen zu bekommen.”
News
ASH 2024: Finales 5-Jahres-Update der OPTIC bei CP-CML Patienten

Im Rahmen der diesjährigen 66. Jahrestagung der American Society of Hematology (ASH) wurden die 5-Jahresdaten der OPTIC-Studie von Ponatinib dargestellt. Dabei gab es Einblicke in Langzeitwirksamkeit, Sicherheit und klinische Relevanz.1
Im Rahmen der diesjährigen 66. Jahrestagung der American Society of Hematology wurden die 5- Jahres-Daten der OPTIC-Studie vorgestellt. Die OPTIC-Studie untersucht die Wirksamkeit und Sicherheit von Ponatinib bei Patient:innen mit chronischer myeloischer Leukämie (CP-CML) nach Unverträglichkeit oder Therapieversagen nach 2G TKI.1
Studiendesign:
Die OPTIC-Studie evaluierte drei Startdosierungen von Ponatinib, um das optimale Nutzen-Risiko Profil zwischen Wirksamkeit und Sicherheit zu finden. Die Patient:innen wurden randomisiert und erhielten Ponatinib in der Dosierung von 45mg, 30mg oder 15mg einmal täglich. Bei Erreichen eines guten Ansprechens (BCR::ABL1IS ≤1%) wurde die Dosis auf 15mg/Tag reduziert.1
Zusammenfassung der Ergebnisse:1
- Langfristige Wirksamkeit: Ponatinib zeigte über 5 Jahre hinweg eine anhaltend gute Wirksamkeit mit hohen Ansprechraten (Nach 60 Monaten erreichten 60% der Patient:innen in der 45-mg-Kohorte ein BCR::ABL1IS ≤1%, verglichen mit 41% in der 30mg-Kohorte und 40% in der 15-mg-Kohorte).
- Hohe Überlebensraten: Die Langzeit-Ergebnisse der OPTIC-Studie unterstreichen den anhaltenden klinischen Nutzen von Ponatinib mit langem Gesamt- sowie progressionsfreiem Überleben (5-Jahres OS: 85,1% bzw. PFS: 63,1% in der 45mg-Kohorte).
- Gut beherrschbares Sicherheitsprofil nach 5 Jahren Follow-Up: Die Ergebnisse waren konsistent mit vorherigen Auswertungen. Die Inzidenz der Grad 3-4 behandlungsbedingten Nebenwirkungen waren in den Kohorten vergleichbar.
Fazit:
Die Ergebnisse der OPTIC-Studie sind konsistent mit vorherigen Analysen und unterstützen die Nutzung von Ponatinib direkt nach 2G TKI bei CP-CML-Patient:innen. Die Daten zeigen ein günstiges Nutzen-Risiko-Profil bei der zugelassenen Startdosis von 45mg täglich, gefolgt von einer Reduktion auf 15mg bei gutem Ansprechen (BCR::ABL1IS ≤1%).1
Auch die ELN-Empfehlungen 2020 bestätigen: Iclusig® ist der potenteste TKI und hat im Vergleich zu anderen TKI die stärkste antileukämische Potenz. Deshalb wird von Experten:innen hervorgehoben, dass Iclusig® bei Patient:innen mit Resistenz gegen einen TKI der 2. Generation bevorzugt verwendet werden sollte. Dies gilt für Patient:innen ohne spezifische Mutationen, bei denen Risikofaktoren einen Einsatz von Ponatinib (im Rahmen der Zulassung*) nicht ausschließen.2
Setzen Sie Iclusig® (Ponatinib) direkt nach dem ersten 2G TKI ein, unabhängig davon ob die Therapie aufgrund von Unverträglichkeit oder Therapieversagen umgestellt werden muss.3,*
Mehr Informationen zur Behandlung der CML mit Ponatinib finden Sie hier.
News
Therapiewechsel in der CML – ELN Empfehlungen und eine retrospektive Studie aus dem Praxisalltag1

Das European LeukemiaNET (ELN) veröffentlichte 2020 Empfehlungen für die Behandlung der chronischen myeloischen Leukämie in der chronischen Phase (CP-CML).2 Der TKI-Wechsel ist empfohlen, wenn molekulare Meilensteine des Therapieansprechens nicht erreicht werden können (siehe Abbildung) sowie auch bei Intoleranz, wenn Nebenwirkungen nicht verbessert werden können.2
Meilensteine des Therapieansprechens laut ELN (1. und 2. Linie)2
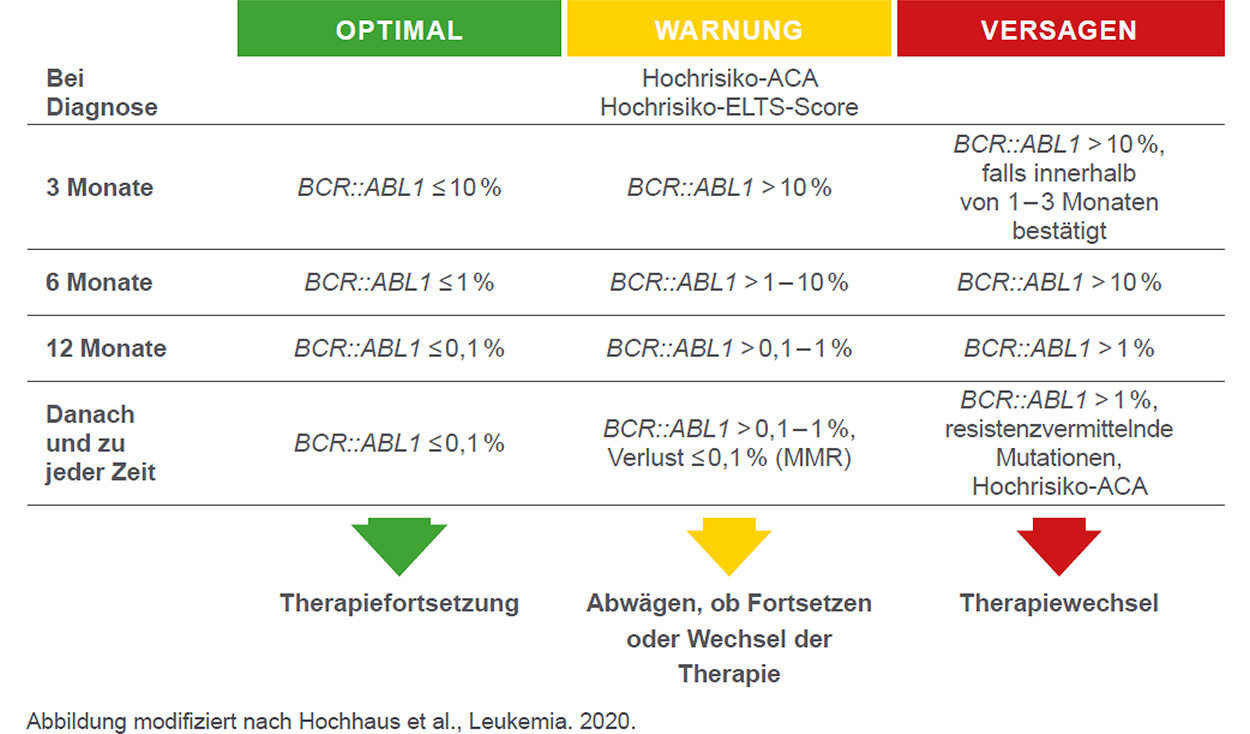
Es wird hervorgehoben, dass Ponatinib bei Patienten mit Therapieversagen gegen einen TKI der 2. Generation bevorzugt verwendet werden sollte. Dies gilt auch für Patienten ohne eine spezifische Mutation, bei denen Risikofaktoren einen Einsatz von Ponatinib (im Rahmen der Zulassung) nicht ausschließen.2
Daten der PACE-Landmark-Analyse bestätigten, dass das Erreichen der Meilensteine (frühes zytogenetisches und molekulares Ansprechen) nach Therapiewechsel auf Ponatinib ein positiver Prädiktor für verbesserte Langzeitergebnisse ist.3
Setzen Sie Iclusig® (Ponatinib) direkt nach dem ersten 2G-TKI ein, unabhängig davon ob die Therapie aufgrund von Unverträglichkeit oder Therapieversagen umgestellt werden muss.4
Wie sieht es im Versorgungsalltag aus? Eine retrospektive Umfrage in Niederlassungen1
Franke GN et al., Ann Hematol, 2024 May;103(5):1569-1575
Daten zur Behandlung von CML-Patienten stammen häufig aus klinischen Studien, die an spezialisierten Zentren durchgeführt werden, während die Primärversorgung häufig in lokalen Niederlassungen stattfindet. Das Ziel dieser Untersuchung war es gezielt die Behandlungssituation in Niederlassungen in Deutschland zu erfassen.
Insgesamt wurden in dieser retrospektiven Umfrage Daten von 819 CML-Patienten aus 43 Praxen ausgewertet. Dabei zeigte sich, dass 35,2% der Patienten im Durchschnitt nach knapp 2 Jahren auf eine Zweitlinientherapie umgestellt werden mussten. Dabei spielten Nebenwirkungen sowie suboptimales Ansprechen und Therapieversagen die größte Rolle.
Patientenkollektiv
- 819 Patienten mit gesicherter CML-Diagnose ab 2013, die mit Tyrosinkinaseinhibitoren (TKI), Interferon oder anderen Therapien, außer Hydroxyurea, behandelt wurden.
Ergebnisse
- Durchschnittsalter: 58,5 Jahre (15-91); 48,6% weiblich (älter als in klinischen Studien)
- Chronische Phase: 84,3%; akzelerierte Phase: 9,4%; Blastenkrise: 0,7%
Therapiewechsel und Monitoring
- 35,2% der Patienten wechselten zur Zweitlinientherapie, wovon 36,8% eine Drittlinientherapie benötigten.
- Im Schnitt wechselten die Patienten nach 21 bzw. nach 17,6 Monaten zur Zweit- bzw. Drittlinientherapie, wobei die Streuung hier sehr hoch war.
- Gründe für den Wechsel der Behandlung:
ca. 40% Nebenwirkungen, ca. 30% suboptimales Ansprechen bzw. Therapieversagen - Zytogenetische Untersuchung:
Zum Zeitpunkt der Diagnose bei 71,8% der Patienten untersucht, sowie nach durchschnittlich 5,75 Monaten bei 215 Patienten (26,3%): 73,0% erreichten komplettes zytogenetisches Ansprechen - Molekulares Monitoring:
Im Durchschnitt ca. alle drei Monate in den ersten zwei Jahren, jedoch war die Streuung hoch, was zeigt, dass einige Patienten kaum und andere sehr engmaschig überwacht wurden. - Molekulares Ansprechen:
- 11,1% der Patienten erreichten kein frühes molekulares Ansprechen nach 3 Monaten in Erstlinie
- Nach 12 Monaten erreichten 5,8% der Erstlinienpatienten nicht den ELN2013- Meilenstein von ≤0,1 % BCR::ABL1IS (Korreliert mit Langzeitüberleben).
- Zweit- und Drittlinientherapie: Anteil der Patienten mit molekularem Versagen (>1% BCR::ABL1IS) nach 12 Monaten Behandlung lag bei 2,9 und 7,2%
- Mutationsanalyse in der ABL1-Kinasedomäne linienunabhängig in weniger als 20% der Patienten: nur 14,2% bzw. 7,1% erhielten eine zytogenetische Analyse vor Beginn der Zweitbzw. Drittlinientherapie.
Schlussfolgerung
- Diese Studie erlaubt einen spannenden Einblick in die CML-Therapie in der realen Welt in Deutschland außerhalb spezialisierter Zentren.
- CML-Patienten werden überwiegend leitliniengetreu behandelt, speziell in Bezug auf das molekulare Monitoring.
- Therapiewechsel infolge von suboptimalem Ansprechen bzw. Therapieversagen erfolgten jedoch nicht in allen Fällen und bei Therapieumstellung erhielt ein substanzieller Anteil der Patienten nicht das adäquate diagnostische Work-Up (Mutationsanalyse, Zytogenetik) analog zu den ELN Empfehlungen, um ein Fortschreiten der Biologie der Erkrankung zu identifizieren.
- Die Behandlungsergebnisse waren generell vergleichbar mit denen aus großen randomisierten Studien bzw. Populations-basierter Analysen.
News
FGFR2-Fusionstestung beim Cholangiokarzinom – Online Seminar der QUIP

FGFR2-Fusionstestung beim Cholangiokarzinom – Online Seminar der QUIP
Anfang Dezember hat das Online Seminar zur FGFR2-Fusionstestung beim Cholangiokarzinom der QUIP stattgefunden. Die Veranstaltung gab wertvolle praxisnahe Einblicke in die aktuellen Entwicklungen der FGFR2-Fusionstestung beim CCA.
Dr. med. Benedikt Westphalen von der LMU Klinik in München schaffte einen Überblick über die Gesamtheit der klinischen Evidenz sowie der Komplexität der Testung und unterstrich dabei die Bedeutsamkeit der interdiszipliären Zusammenarbeit zwischen Pathologie und Onkologie. Er eröffnete die Veranstaltung mit einer eindrucksvollen Aussage über die untrennbare Verbindung von Diagnostik und Therapie beim cholangiozellulären Karzinom (CCA), die im Sinne der Patienten von entscheidender Bedeutung sei, denn „ohne molekulare Diagnostik riskieren wir, einen signifikanten Anteil unserer PatientInnen unterzubehandeln“.
Für die Details der Testung aus pathologischer Perspektive präsentierte Prof. Dr. med. Albrecht Stenzinger vom Universitätsklinikum Heidelberg eine detaillierte Analyse der FGFR2-Fusionstestung. Anschließend wurden die methodischen Aspekte der FGFR2-Fusionstestung sowie die Vor- und Nachteile der verfügbaren Detektionsmethoden durch Herrn Dr. rer. nat. Daniel Kazdal (Universitätsklinikum Heidelberg) zusammengefasst.
Für weitere Details und eine vollständige Aufzeichnung der Veranstaltung, finden Sie das gesamte Video hier.